РЕЗЮМЕ НА ИЗОБРЕТЕНИЕТО
Някои проявления на настоящото изобретение са принципно насочени към предоставянето на изолиран антивирусен пептид, който се характеризира от аминокиселинната последователност GDEPLENYLDTEYF (SEQ ID:NO 1) и значителна склонност към свързване ин витро с gp120, gp 41 на ХИВ-1 и човешки CD4 клетки. Пептидът проявява анти-ретровирусна активност ин виво, особено анти-ХИВ-1 активност. Пептидът,споменат в настоящото като НФП (неактивиран фрагмент на пепсиногена) е изолиран от свински пепсиноген, пречистен и необратимо деактивиран с цел приложение в свързани с ХИВ-1 профилактични, терапевтични и диагностични процедури.
Други проявления на настоящото изобретение са като цяло насочени към предоставянето на фармацевтични съставки, които обхващат НФП и методи за предотвратяването,лечението и диагностицирането с тези съставки на ХИВ-1 инфекции и заболявания,свързани с ХИВ-1, като например СПИН (синдром на придобита имунна недостатъчност) и ARC (свързан със СПИН комплекс).
ПОДРОБНО ОПИСАНИЕ НА ИЗОБРЕТЕНИЕТО
Пепсините(сред които има няколко изоензима) са основните протеази в стомашните секреции на възрастни бозайници. Те принадлежат към групата на аспартатните протеази и се синтезират и излъчват от клетки в стомашната лигавица като неактивни ензимни прекурсори, които се състоят от сигнален пептид, активиращ пептид и активен ензим, чието действие е потиснато. Докато се придвижва към лумена на стомаха за смилане на стомаха, сигналният пептид се дели, за да се излъчи неактивен проензимен пепсиноген, който при излагане на ниско стомашно pH (<4), на свой ред се дели, за да се получи зрял, каталитично активен пепсин.
Пепсинът при свинете е един от първите изследвани ензими и е аспартатната протеаза, чиято структура е най-добре проучена. Тя е съставена от 327-аминокиселинни (аа)остатъци и молекулна маса от 34 kDA (PNAS (САЩ)70:3437-39 1973). Протеолитната активност на пепсина е най-висока при pH от около 1,8 до 3,5;деактивира се при pH от около 5 и се деактивира (денатурализира) необратимо при pH от около 6-7.Благодарение на тяхната значимост, аминокиселинните остатъци, свързани с(активния) център на свързване на субстрата, са в основата на много изследвания. Но очевидно остава все още недоизяснено колко от функционалната активност, ако има такава, е повлияна от останалата част на пептида.
Фамилията аспартатни протеази (аспартази) се характеризира с аспартатни киселинни остатъци към техните активни (каталитични) центрове. Човешкият пепсин например има два аспартатни остатъка, свързани към активен център (с код „D“ или „Asp“). Също така фамилията включва ХИВ протеаза (и нейните многобройни варианти), които включват идентични вериги, всяка от които има единичен остатък, свързан към активен център. От основно значение за съзряването на новосинтезирания вирус, който се изразява като полипротеин, тази протеаза се превърна в желана цел за изследователите, които целят блокирането на размножаването на ХИВ вируса.
Има данни, че пептидът на настоящото изобретение, който се характеризира с аминокиселинната последователност GDEPLENYLDTEYF (-Gly-Asp-Glu-Pro-Leu-Glu-Asn-Tyr-Leu-Asp-Thr-Glu-Tyr-Phe-), се свързва ин витро с gp41 и gp120 части на ХИВ-1 и човешкиCD4 клеткии се очаква да прояви анти-ретровирусна дейност ин виво, по-специално да потисне навлизането на ХИВ-1 в човешките CD4+ клетки.
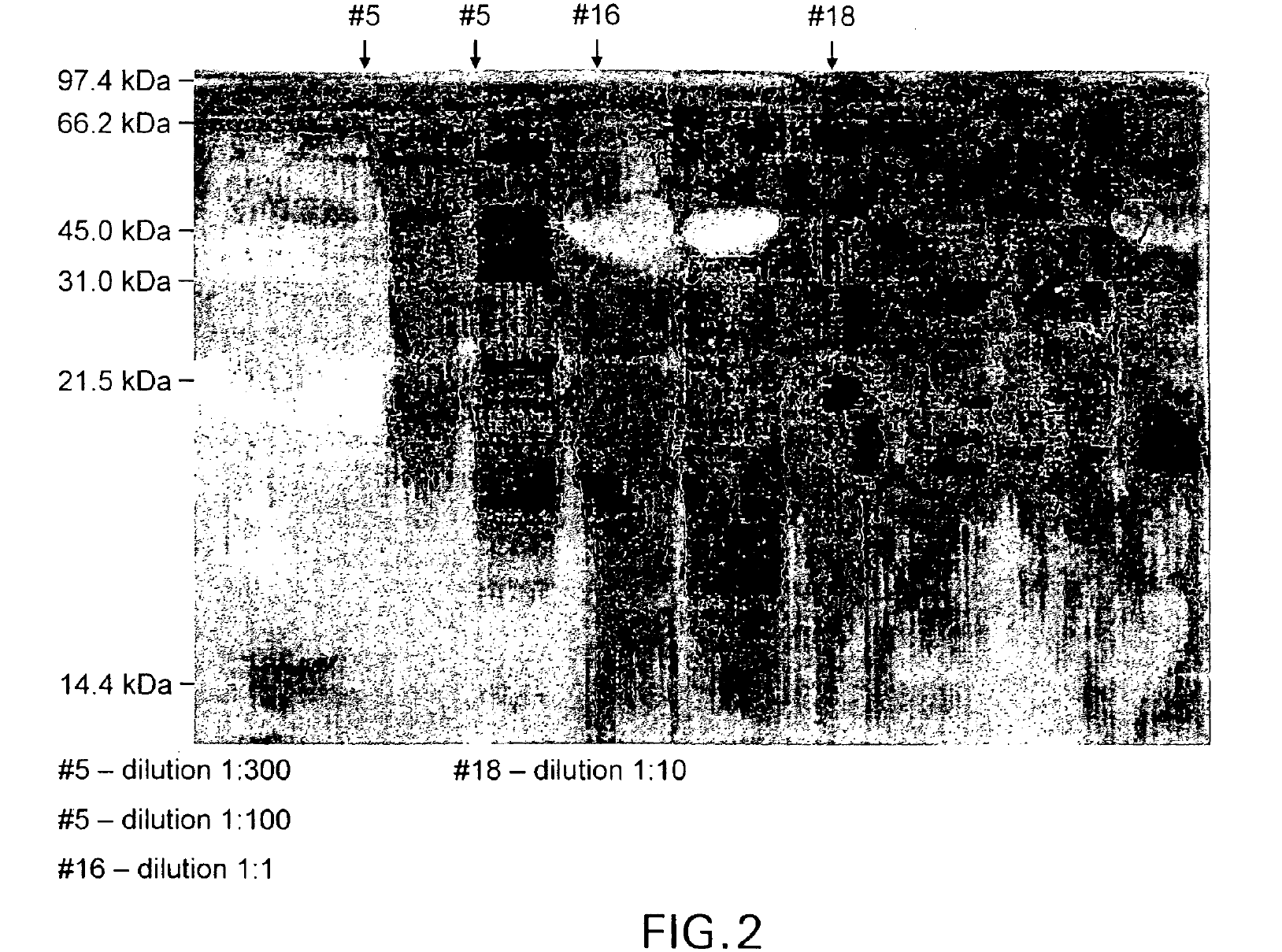
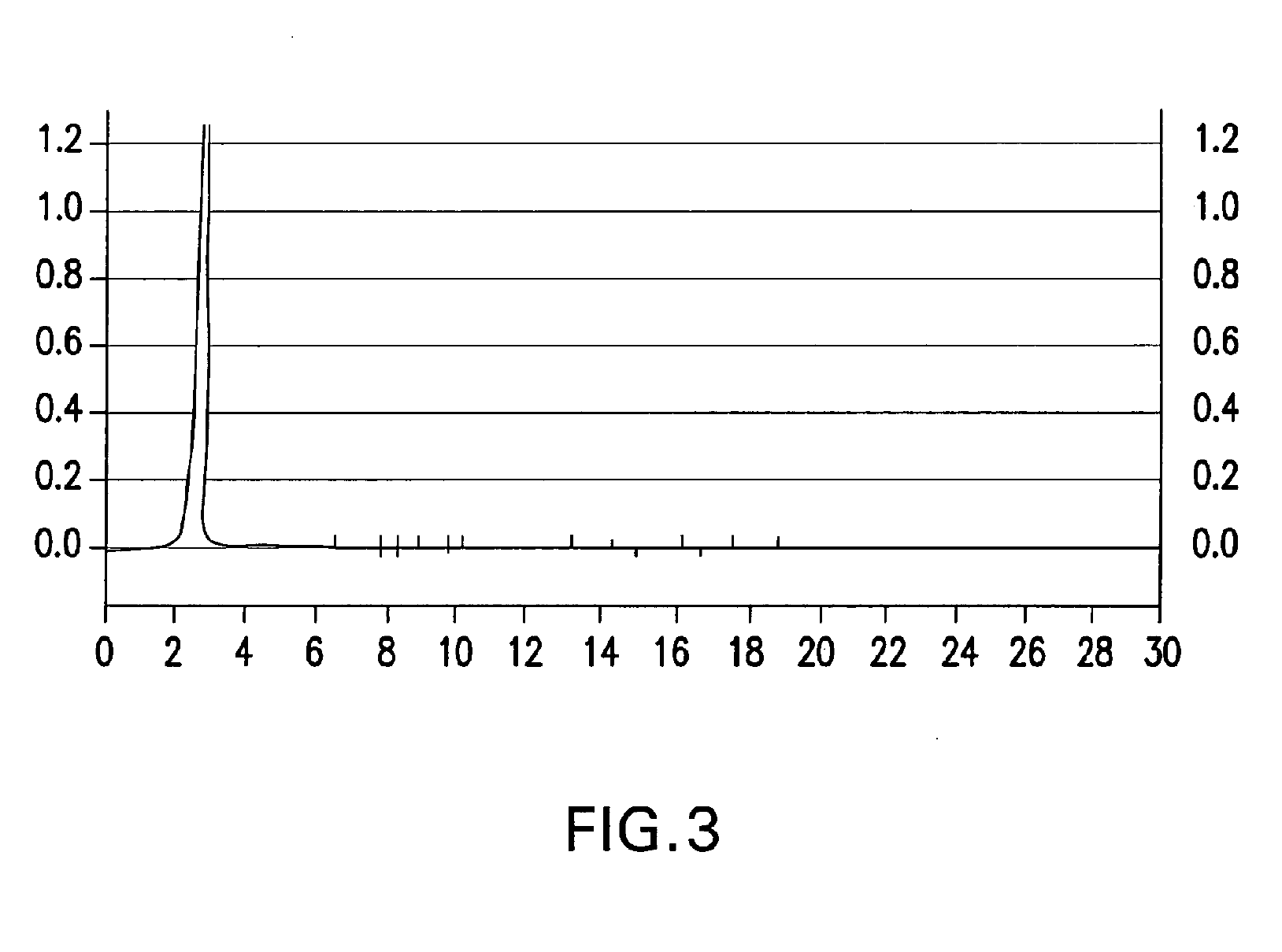
Пептидът от този пример бе получен от свински пепсиноген (ФИГ. 1) чрез изолирането му от НФП препарат от диапазона 45 kDa в условията на електрофореза с помощта на гел (ФИГ. 2,примерите, споменати по-долу). Той може да се получи и от пепсиноген на който и да било друг източник, който съдържа тази последователност или от всеки друг пептид или протеин, който съдържа тази последователност, благодарение на разположение на пазара има продукти, от които може да бъде извлечен пепсиноген. Могат да се използват общи лабораторни методи и реагенти на избирателно разделяне на интактен протеин, както и такива за изолирането и подреждането на разделените пептиди, като например чрез реакцията на разграждане по Едман. Пептидът може да се получи чрез синтез на пептид, като се използват традиционни методи. Нещо повече, генетично разработените съединения, които изразяват интересуващата ни последователност като правило са за предпочитане, въпреки че могат да се използват и химично синтезирани съединения. Пептидите в НФП сегментите могат да се изолират и концентрират от всяка една от техниките, които са добре познати на посветените в областта, като например утайка на амониев сулфат. Изолираният пептид може да се пречисти чрез стандартни процеси, като например филтрация с гел и високо ефективна течна хроматография при висока резолюция (RP-HPLC) и деактивира, както бе обсъдено по-горе чрез излагане на неутрална до основна среда от около pH 6.5 или повече или по друг известен начин. Пептидът може също така да бъде алкилиран с цел повишаване при желание на имуногенността например чрез процес, описан по-горе за целите на метилирането на транскрибиращия фактор в Заявлението за публикация на патент от САЩ US 2004/0018639 A1.HPLC хроматограма на пречистения неактивиран НФП продукт на изобретението е показан във ФИГ. 3.

Хомолозите или аналозите на последователността, които съхраняват поне аминокиселинните структури и функции, които се явяват центрове за свързване от първостепенно значение и също така съхраняват всякакви отдалечени структурни/функционални остатъци от основно значение за свързващата дейност, както е описана тук, могат да бъдат заместени за НФП на SEQ ID:NO 1. Вариантите на последователността, включително химично модифицираните производни със силна прилика в последователността ще бъдат като цяло за предпочитане, при условие че дейността по свързване не е значително повлияна в отрицателна насока.Остатъците, които не са необходими за оповестената функция на пептида от изобретението могат да бъдат изтрити или добавени със същата уговорка.Съхранението на дейността по свързване на модифицираните последователности могат да се оценяват например съгласно опитите за свързване, описани тук или в литературата. Многобройните бази данни са на разположение за анализ на последователността на протеина, като например тези, които съчетават приликата на последователността с разпознаването на сгъването с цел предсказването на функционалните еквиваленти. Свойствата за свързване (афинитет, специфичност и т.н.) могат също да бъдат оценявани по опитите за свързване, описани по-долу или други стандартни опити, извършвани в областта.
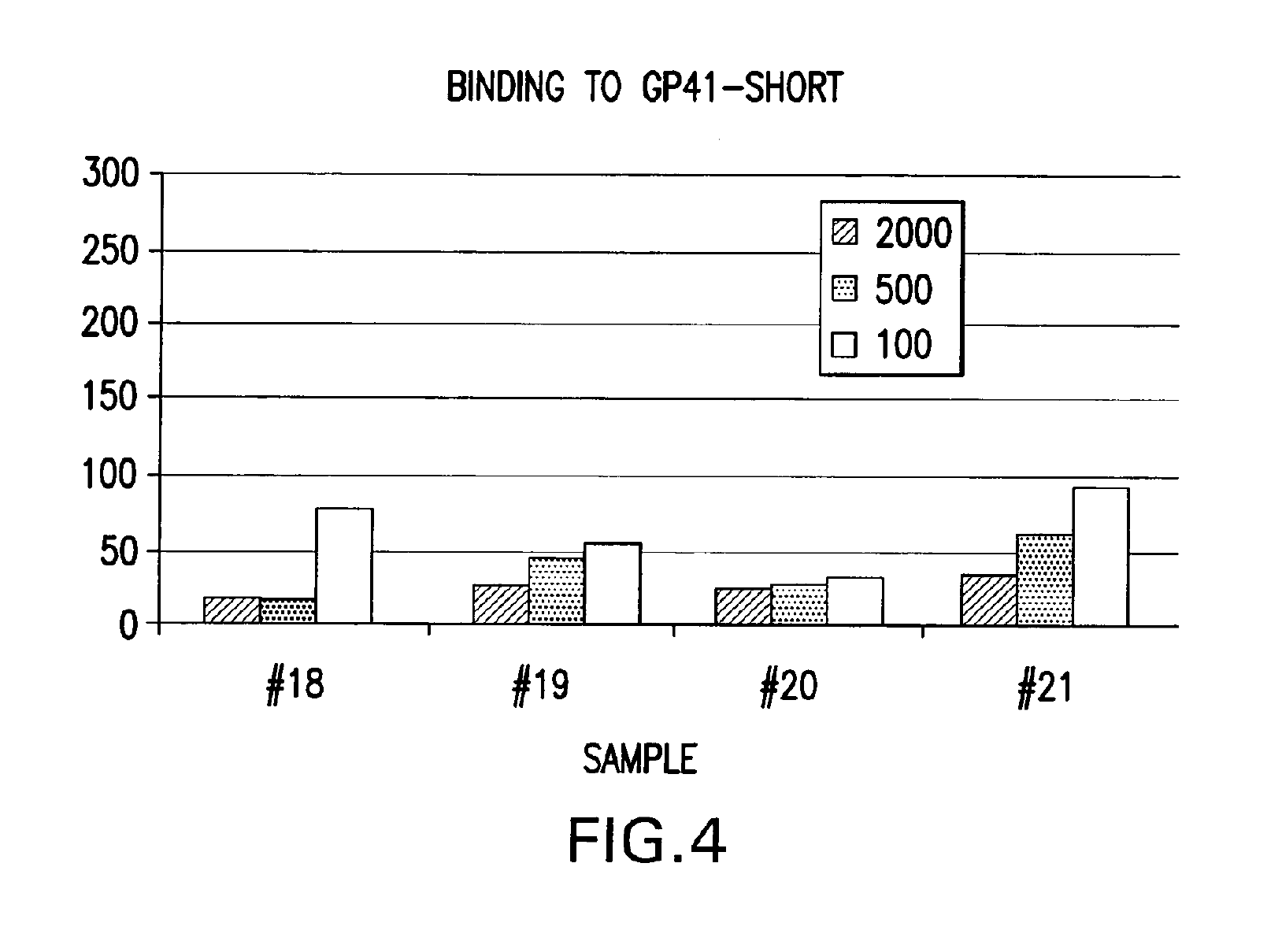
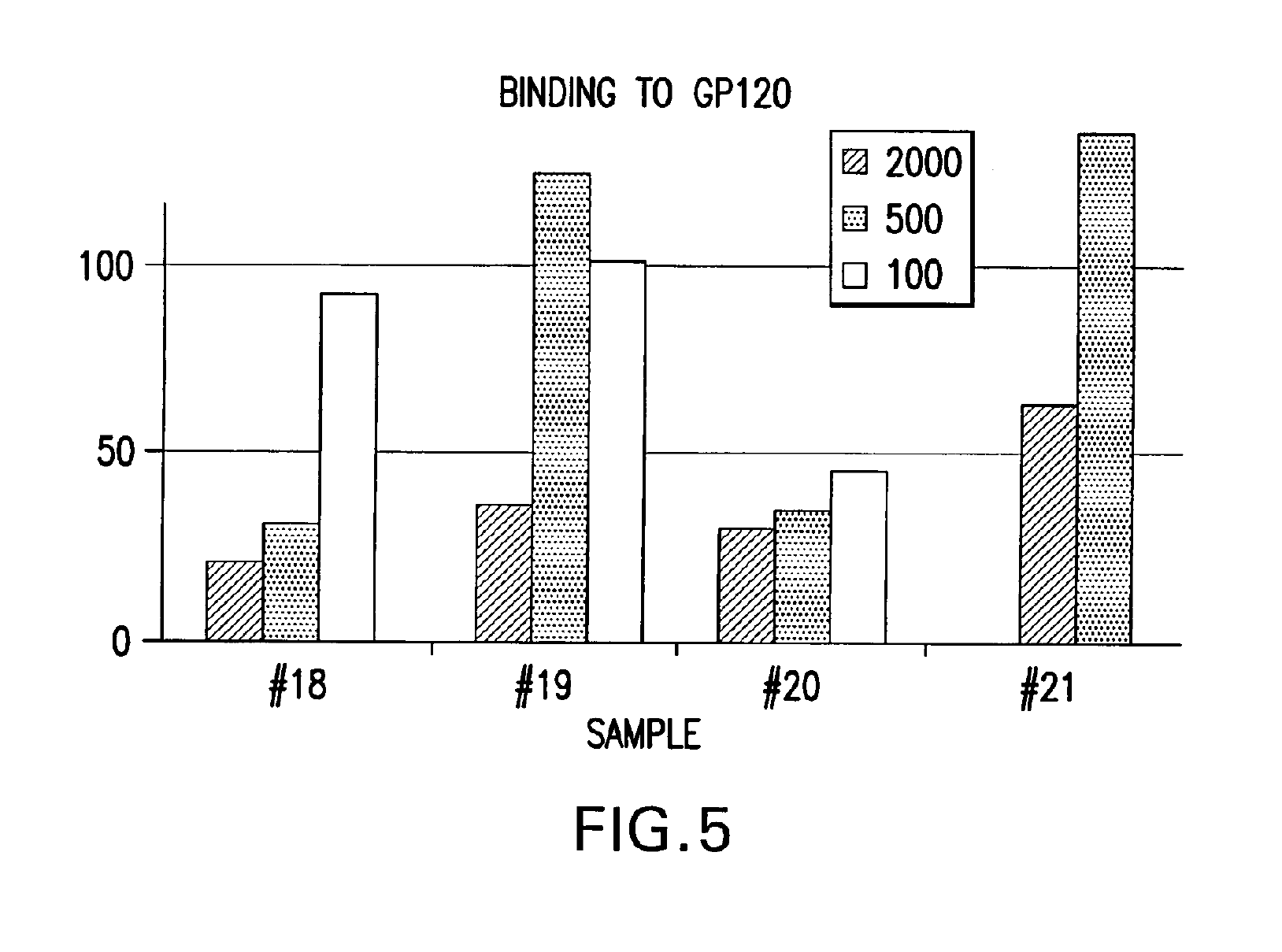
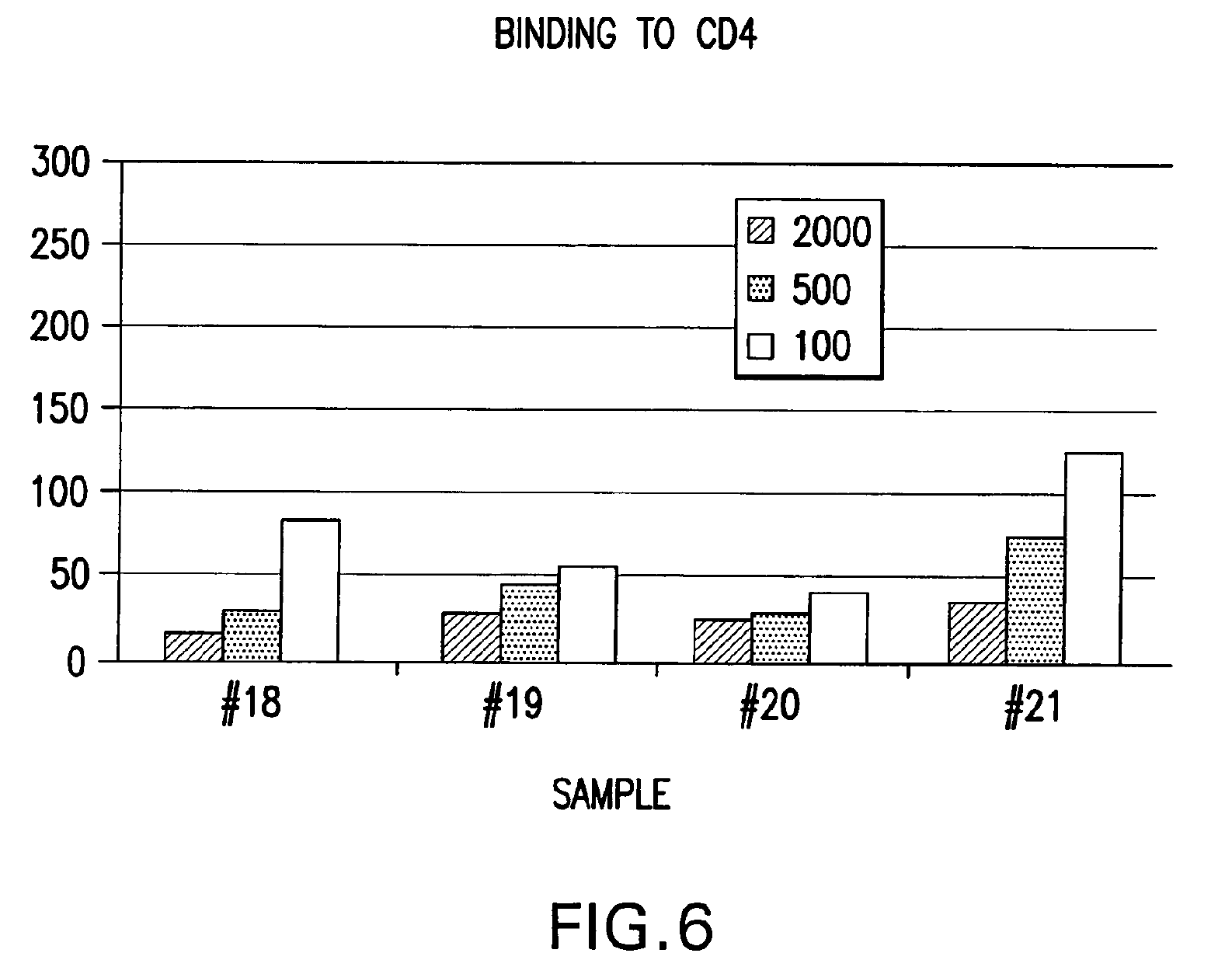
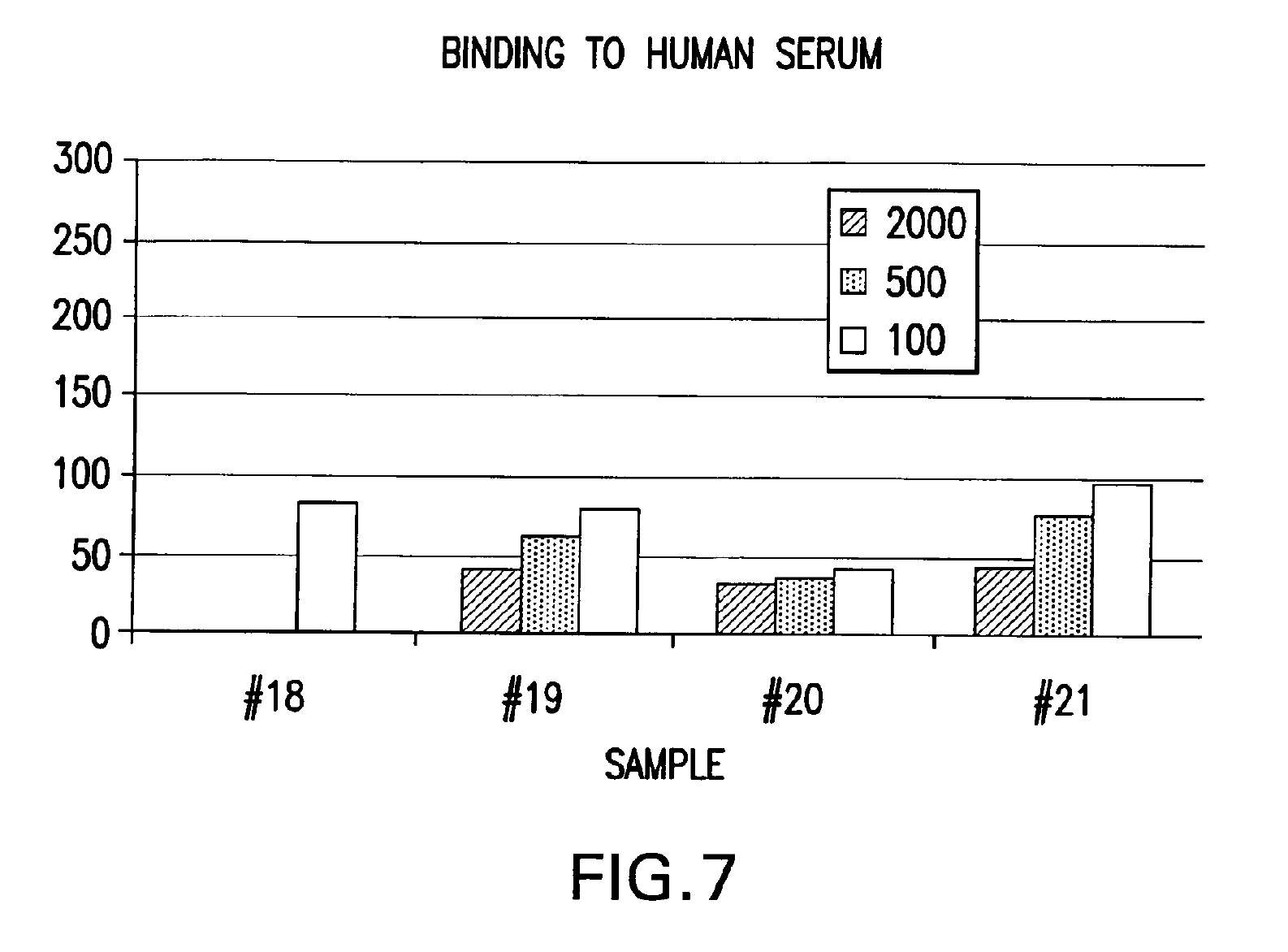
НФП се свързва ин витро с негликолизиран фрагмент 579-601 на ХИВ-1 с обвивка от gp41 част на протеина (ФИГ. 4 и 8), с gp120 ХИВ-1част (ФИГ. 5), с човешки CD4+ клетки (ФИГ. 6) и с човешки серум (ФИГ. 7) при електрофореза с помощта на гел. Спонтанното свързване на НФП с gp41 под част е билогично свойство от особено голямо значение. Освен това, при обикновена електрофореза с агарозен гел, НФП и gp41 се движат в противоположни посоки. Освен това, когато се смесят преди електрофореза, gp41 променя посоката и поема тази на НФП. Количественият анализ сочи, че коефициентът на свързване на НФП към gp41 е 1:0.66. Т.е. три молекули на НФП се свързват с две молекули на gp41 и образуват комплект,който може да функционира ин виво като например суперантиген със значителна анти-ХИВ-1 биологична активност. Такъв антиген може да се използва като реагент при биологични опити за образуването на моно- или поликлонални антитела в производството на ваксини и в други приложения, в които обикновено се ангажират антигени. Докато механизмът на тези свързващи събития към момента все още не е разбран докрай, се счита, че излагането на ХИВ-1 на НФП от настоящото изобретение ефективно ще блокира зони от gp41 и gp120 от основно значение за проникването на вируса в CD4+ клетки и потискането на вирусната инфекция, ин виво и ин витро. Също така се счита, че НФП от настоящото изобретение ефективно ще се конкурира с ХИВ-1 чрез центровете за свързване по повърхността на CD4+ клетките и потискат навлизането на вируса в тези клетки, ин виво и ин витро. Различни ин витро протоколи са известни в научните среди с предвиждането на антивирусната дейност на съединенията ин виво и с потискането на размножаването на ХИВ и тези протоколи могат да се използват във връзка с практиката на настоящото изобретение. Известни в средите примерни опити за скрининг на ХИВ са цитирани в Патент на САЩ № 5,869,522, издаден на 9 февруари 1999 г. на Бойд и сие,включително тези, описани в J.Virol.Methods, 33:87-100,1991; J.Natl.CancerInst., 81:577-586,1992; i J.Med.Chem 35:1978-1986, 1992 и М.Р. Бойд в AIDSEtiology: Diagnosis, Treatment and Prevention, стр.305-319 (Lippincott, 1988, DeVita, V.T., Jr. et al., eds). В съответствие с един аспект от настоящото изобретение, НФП се използва за диагностика на вирусната инфекция, по-специално на вируса ХИВ-1. Биологичните опити, подходящи за тази цел са добре познати и стандартни. Типични за тях са опитите, основани на конкурентното свързване между например известно количество вирусен протеин и биологична проба, която се изпитва за наличие на същия вирусен протеин, като се използва излишък от антивирусен реагент, който е способен да се свърже именно с известния протеин, като например с антитяло. Тяхна смес се поставя в инкубатор,а количеството свързан комплекс се изчислява и съпоставя с контролната смес, в която липсва пробата. Тогава може да се определи присъствието, ако изобщо има такова, и количеството вирусен протеин в пробата. Съществуват най-различни разновидности на този процес, като например опити тип „сандвич“, опити с имобилизиран реагент, опити с маркиран реагент (например ELISA, RIA, FIA) и т.н. Каквато и да е разновидността, независимо дали става дума за комплексът за откриване или задаване на количествена стойност, или за допълнителни реагенти, или друга модификация, всички те изискват свързващ агент за неизвестната проба. Така всеки от тези стандартни опити за свързване за задаване на количествена стойност или идентифициране на неизвестна проба могат да се използват в рамките на настоящото изобретение, като НФП се замества като антивирусния свързващ агент за проби, които ще бъдат проверени за наличие на ХИВ-1 gp120,gp41 или за заразени CD4+ T-клетки.

В съответствие с друг аспект от настоящото изобретение, НФП се използва като профилактично или терапевтично средство с цел предотвратяване или лечение на ХИВ инфекции. (Тук под понятието „ХИВ инфекции“ се разбира СПИН или ARC, в допълнение към вирусната инфекция сама по себе си, освен ако не е посочено друго). За употреба ин виво, НФП може да се подготви за прилагане чрез смесването му до желаната степен на чистота с фармацевтично-приемлив носител, подходящ за начина на приложение, както е добре известно в средите. Въпреки че е желателно в някои приложения НФП да се прилага заедно със спомагателно вещество, в случаи, когато се прилага серия от НФП дози е възможно подсилващите НФП вещества да не се нуждаят от спомагателно вещество. Понастоящем мускулните и подкожните инжекции са предвижданият начин на прилагане на НФП, както за терапевтични, така и за профилактични цели. Но венозното приложение, приложението чрез катетър или друга хирургична тръбичка или друго парентерално приложение също могат да се използват. Алтернативни начини са пероралният прием на таблетки, течни форми и други подобни, както и чрез вдишване. Могат да се използват и течни форми, получени чрез разтваряне на смеси на прах. НФП може да се администрира и чрез микросфери, липозоми или други микрочастици, както и чрез системи за доставка или за продължително освобождаване в някои тъкани, като например кръвта.
Дозировката на приложения НФП ще зависи от свойствата на използваната форма, например нейната свързваща активност и плазмен полуживот, ин виво, концентрацията на НФП във формата, начина на приложение, центърът и честотата на дозировката,клиничния толеранс на съответния пациент, здравословното състояние на пациента и други съображения, които се отчитат в средите. Различните дозировки могат да се използват по време на серия от последователни лечения. Практикуващият лекар може да приложи първоначална доза и след това да я подсили със сравнително по-малки дози НФП. Дозировките на НФП могат да се комбинират с други ХИВ антивирусни средства, като например AZT.
По-долу е поместен пример на планирана форма, дозировка и схема на приложение за НФП:
На пациента е приложена мускулна инжекция, която съдържа 8 mg НФП (за предпочитане 2 ml от сместа, която съдържа 6 mg/ral НФП във фармацевтично приемлив разтвор) или 57 μg НФП протеин на килограм телесна маса на пациента. Всеки курс на лечение се състои от 16 инжекции, като в продължение на 8 седмици ежеседмично се прилагат по две инжекции в два последователни дни. Три месеца след последната инжекция, ако състоянието на пациента го позволява, курсът на лечение се повтаря. Курсът на лечение може да се повтаря до получаването на удовлетворителни резултати,например спиране или забавяне на развитието на инфекцията или болестта,облекчаване на действието на инфекцията или болестта или до пълно излекуване.За предпочитане в настоящото приложение е НФП да се прилага съвместно с алуминиев хидроксид (Al(OH)3) като спомагателно вещество. Алуминиевият хидроксид е спомагателно вещество с широко приложение, особено в продукти, които се продават в търговската мрежа, като например ваксини. Има добро действие при съвместно прилагане със силни антигени. Спомагателното вещество е налично в търговската мрежа с търговското наименование Alhydrogel®, продукт на Accurate Chemical& Scientific Co. от Уестбъри, Ню Йорк, САЩ. Например последният 1 ml окончателната формула на НФП може да съдържа: 4 mg НФП (чистота> 96% ± 0.290); 2.25 mg 0.016МAIPO4 (или0.5 mg Al+3); 4.1 mg 0.004M CH3COONa; и12.9 mg C6H5О7(натриев цитрат); рН 6.2.В рамките на курс на лечение 2 ml от тази смес съставлява една ампула, като дневната доза на един пациент е 16 ампули. По време на курса на лечение пациентът следва да бъде поставен под наблюдение с цел оценка на ефективността на курса на лечение. Кръвната картина,по-специално на състоянието на CD4+ клетките са от полза, както и общата методология за оценка на ХИВ инфекцията, а също и пробите за антитела или титри в Т-клетките.
ПРИМЕРИ
Изолация и пречистване на необратимо неактивен фрагмент на пепсина.
Следните примери показват как се изолира, пречиства и характеризира НФП от активен свински пепсиноген. Също така се илюстрира свързващата дейност на НФП.
ПРИМЕР i
Изолиране и деактивиране на фрагмент от пепсиногена
Всички буфери и разтвори, които се използват в настоящия раздел, се стерилизират чрез филтрация. Ако е необходимо буферите (0.2 Nили 0.1 N HCl) се използват за регулиране на разтворите. Всички химикали, включително дестилираната вода за изготвянето на буфери и разтвори са съгласно американската фармакопея. Съотношението на пепсина спрямо буферите е 1:4(маса/маса).
НФП се изолира от активния пепсин (Сигма 1:10000) с утайка на амониевия сулфат чрез центрофугиране при 4°С. Лиофилизираният прах на пепсина се разтваря в 0.14М натриев хлорид (NaCl), 0.05M натриев ацетат (CH3COONa.3H2O), 0.05M натриев цитрат (C6H5O7Na2.H2O), и 0.20N HCl (pH 2.8-3.2)буфер. рН на суспензията от активен пепсин се повишава до 6.2-6.6 и суспензията се инкубира в продължение на 30 минути. След това суспензията се утаява с наситен разтвор от (NH4)2SO4. След разграждането, сместа се центрофугира (8000 оборота в минута при 4°С) за 60 минути и изхвърлянето на изплувалия на повърхността разтвор. Пелетът се разтваря в минимално количество 0.14М NaCl, а получилият се разтвор се диализира в продължение на 18 ч. за извеждане на буфера от диализния разтвор; 0.1М NaCl, 0.1M натриев ацетат и 0.02М тимерозал (съгласно фармакопоеята на САЩ), pH 6.8.
ПРИМЕР II
Пречистване и възстановяване на необратимо неактивиран фрагмент на пепсиногена
Пречистването на НФП включва следните фази: диализа, центрофугиране, филтрация на гел и обратно-фазова високоефективна течна хроматография (HPLC). След диализата, диализатът с ниско молекулно тегло се центрофугира със скорост от 15000 об./мин. при температура от 4°С зa 60 минути (ротор на Бекман) с утайка от остатъчен амониев сулфат. Продуктът се пречиства с филтрация с гел за възстановяване на пречистената НФП форма от първоначалната смес и след това се пречиства чрез филтрация с геловете Bio-gel P10 или Sephadex G-75 (на Pharmacia Uppsala, Швеция)или 0.2 μ мембрана от целулозен ацетат без повърхностно активни вещества (Nalgene Labware, Рочестър, Ню Йорк, САЩ).Допълнително пречистване се постигна чрез обратно-фазова високоефективна течна хроматография (RP-HPLC) в RP-HPLC системата GOLD (Beckman) в колони С-18 (обратно-фазов ултра сферичен 10 mm сферичен 80А препарат 21.2х150 mm), който използва 30% разтвор на ацетонитрил в дестилирана вода, клас HPLC при 15% метанол, клас HPLC мобилна фаза. Откриване 254 nm; скорост на потока от 0.850 ml/min, разтвор при pH 6.8.Последната фаза в пречистването включва стерилна филтрация с 0.45μ филтър на Nalgene. Профилът на отмиване в следствие на високоефективната течна хроматография на продукта показа един-единствен връх, НФП (вж. ФИГ.3).
ПРИМЕР III
Определяне на молекулната маса
Молекулната маса се определи с нередуцирана електрофореза с помощта на 13% натриев додецил-сулфат и полиакриламиден гел, потопен в сребро, като се използва метода на Laemmli (Nature 227-670, 1970). Стандартът за молекулно тегло показа един пептид с молекулно тегло от 45 000 KD (ФИГ.2). Този диапазон бе изолиран, а HPLC хроматограмата (ФИГ. 3) потвърди наличието на един-единствен пептид в диапазона.
ПРИМЕР IV
Оценка на активността при свързване
НФП пробите (№18, 19, 20 и 21) се използваха за откриване на свързване с gp120,gp41, CD4+ клетки и серум от здрав пациент. Нови чипове бяха обвити с тези протеини и бяха извършени опитите на Biacore за активност при свързване. Тези проби бяха разтворени в съотношение 1:2000, 1:500 и 1:100. Резултатите са изобразени на ФИГ. 4,5, 6 и 7. Проба №21 се свърза с всички целеви протеини по-добре от всички останали проби. В опита беше използвана системата на Biacore (Biacore AB, Упсала, Швеция), въз основа на сензорни чипове, които предоставят повърхностните условия за прикрепване на молекули от интерес, микрофлуидна поточна система за извеждане на пробите на повърхността и за повърхностна плазмена реакция (SPR), която открива концентрация на маса на повърхността. Базираните на SPR биосензори наблюдават взаимодействията, като измерват молекулната маса, свързана към повърхността.Тази реакция се измерва в резонансни единици (RU), при което промяната в концентрацията на 1 pg/mmе равна на промяна от 0.0001 в ъгъла на минималния интензитет, който е равен на една RU. Точният коефициент на преобразуване за RU зависи от свойствата на сензорната повърхност и характера на молекулата, която отговаря за промяната в концентрацията. Опитите сочат, че се образува суперантиген, който провокира реакция на имунната система.
ПРИМЕР V
Поглъщане на ултравиолетови лъчи
Кръговият дихроизъм (CD) дава информация за вторичната структура на оптично активните материали. В крайната УВ или амидна зона (170-250nm) се доминира от приноса на пептидни връзки, докато CD диапазоните в близката УВ зона (250-300nm)възникват от ароматните аминокиселини. УВ зона на НФП е в обсега на 252-260 nm.
Лице с опит в областта би оценил примерните данни, посочени по-горе, единствено като илюстрация на общите принципи на настоящото изобретение. Могат да се извършат и други модификации или изменения, без да се излиза извън обсега на изобретението. Така например, но без да се ограничава до, могат да се използват алтернативни конфигурации в съответствие с посочените тук инструкции. Съответно фигурите и описанието са приведени само с цел илюстрация и нямат за цел да поставят ограничения.
Освен това всички понятия трябва да се тълкуват във възможно най-широкия им смисъл съобразно контекста. По-специално понятията „обхваща“ и „обхващащ“ следва да се тълкува като обхващащ елементи, компоненти или стъпки по неизключителен начин,като се посочва, че споменатите елементи, компоненти или стъпки могат да присъстват, или да се използват, или комбинират с други елементи, компоненти или стъпки, които не са били изрично споменати. Ето защо се препоръчва изобретението да включва всички негови варианти и вариации, до толкова доколкото те попадат в обсега на приложените претенции и техните еквиваленти.
Иммунотех IPF
· Единствена по рода си, патентована ХИВ/СПИН терапия
· Активира имунната система да се бори с ХИВ инфекциите - не постижимо с други терапии
· Възпира инфекцията на CD4 Т-клетките от ХИВ
· Повишава нивата на CD4 Т-клетките до здрави нива
· Намалява ХИВ вирусния товар
ДВА РЕЖИМА НА ДЕЙСТВИЕ
1. Директно възпрепятства ХИВ вируса да инфектира CD4 Т-клетките
2. Активира Th1 имунния отговор, с други думи, включва макрофагите които всъщност поглъщат самия ХИВ, Т-лимфоцитите убийци които унищожават ХИВ-инфектираните клетки и други борещи се с ХИВ имунни отговори.
Единствената ХИВ/СПИН терапия постигаща това
РЕЖИМ 1
Като прикрепя специфични протеини до външното покритие на ХИВ частицата, Иммунотех IPF директно възпира ХИВ вируса да инфектира CD-4 T клетките. ХИВ gp 120 се прикрепя към CD4 на Т-клетките и след това към ко-рецептор.
Причинява закрепване на gp41 към клетъчната мембрана = сливане на вирусната клетка и ХИВ инфекцията.
IPF инактивира gp120 и gp41 = без прикрепване на ХИВ към клетките и без ХИВ инфекция.
РЕЖИМ 2
Иммунотех IPF се прикрепя към Т-клетките и включва Th1 имунния отговори които убиват ХИВ вируса и инфектираните с ХИВ клетки.
Не се извършва от никоя друга ХИВ/СПИН терапия. IFN-γ, IL-2 и TNF-a са цитокини, малки протеини пуснати от Т-клетките и получени от други клетки за създаване на специфичен имунен отговор.
Настоящите Антиретровирусни Терапии имат сериозни ограничения:
ХИВ инфекциите са най-лечими по време на ранните етапи на болестта;
Но пациента не може да приема антиретровирусни по време на ранните етапи, защото често се развива резистентност към лекарството;
Това означава ограничени или никакви възможности за лечение когато вирусния товар броя на CD4 клетките са в най-тежка фаза, тоест при СПИН.
Не-антиретровирусни лечения като Иммунотех IPF липсват, но са изключително нужни.
ИММУНОТЕХ IPF ПРЕДИМСТВА
Заменя или допълва настоящи антиретровирусни терапии
По-евтино и без токсичност
Ефективно като еднократна или периодична терапия вместо като дневна
Не засегнато от ХИВ мутации които могат да пречат на антиретровирусните терапии (HAART)



